Khử 48 gam sắt (III) oxit bằng khí hiđro. Hãy tính số gam sắt kim loại thu được? Thể tích khí hiđro (đktc) cần dùng? Thể tích khí oxi (đktc) cần dùng khi tác dụng với hiđro để tạo ra lượng nước gấp đôi lượng nước trong phản ứng trên.

Khử 48 gam sắt (III) oxit bằng khí hiđro. Hãy tính:
1 – Số gam sắt kim loại thu được?
2 – Thể tích khí hiđro (đktc) cần dùng?
3 – Thể tích khí oxi (đktc) cần dùng khi tác dụng với hiđro để tạo ra lượng nước gấp đôi lượng nước trong phản ứng trên.
Lời giải
Công thức hóa học của sắt (III) oxit là Fe2O3
Khí hidro có công thức hóa học là H2
Số mol oxit sắt là
Phương trình phản ứng
Fe2O3 + 3H2 → 2Fe + 3H2O (1)
Theo bài ra ta có
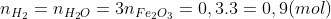
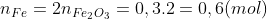
1 – Số gam sắt thu được là
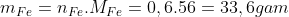
2 – Thể tích khí H2 cần dùng là
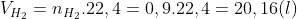
3 – Phản ứng tạo thành nước khi cho H2 tác dụng với O2 là
2H2 + O2 → 2H2O (2)
Ta gọi số mol H2O ở phản ứng 1 có số mol là n1 và số mol H2O ở phản ứng 2 có số mol là n2. Khi đó, để tạo ra lượng nước gấp đôi tức là số mol nước ở phản ứng 2(n2) cũng gấp đôi số mol nước ở phản ứng 1(n1). Ta có:
n2 = 2.n1 = 2.0,9 = 1,8 (mol)
Theo phản ứng (2) ta có:
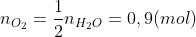

1 – Số gam sắt kim loại thu được?
2 – Thể tích khí hiđro (đktc) cần dùng?
3 – Thể tích khí oxi (đktc) cần dùng khi tác dụng với hiđro để tạo ra lượng nước gấp đôi lượng nước trong phản ứng trên.
Lời giải
Công thức hóa học của sắt (III) oxit là Fe2O3
Khí hidro có công thức hóa học là H2
Số mol oxit sắt là
Phương trình phản ứng
Fe2O3 + 3H2 → 2Fe + 3H2O (1)
Theo bài ra ta có
1 – Số gam sắt thu được là
2 – Thể tích khí H2 cần dùng là
3 – Phản ứng tạo thành nước khi cho H2 tác dụng với O2 là
2H2 + O2 → 2H2O (2)
Ta gọi số mol H2O ở phản ứng 1 có số mol là n1 và số mol H2O ở phản ứng 2 có số mol là n2. Khi đó, để tạo ra lượng nước gấp đôi tức là số mol nước ở phản ứng 2(n2) cũng gấp đôi số mol nước ở phản ứng 1(n1). Ta có:
n2 = 2.n1 = 2.0,9 = 1,8 (mol)
Theo phản ứng (2) ta có:
Tác giả: TC – Chemistry, TC-Chemistry

Với đam mê truyền đạt và chia sẻ những kiến thức hóa học hữu ích với mọi người, TC Chemistry không chỉ giới hạn việc chia sẻ kiến thức hóa học từ cơ bản đến nâng cao, mà còn cung cấp câu hỏi, đề thi thử và phương trình phản ứng hóa học để giúp người đọc hiểu sâu về chủ đề và phát triển kỹ năng trong lĩnh vực này.